Dynein
 Kubo et al., PLoS Comput. Biol. (2017)
Kubo et al., PLoS Comput. Biol. (2017)
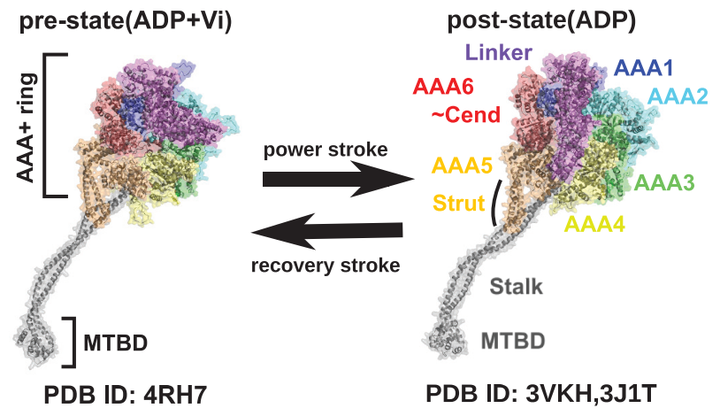
ダイニンはATPの加水分解から得られる自由エネルギーを利用して微小管上をマイナス端方向に二足歩行運動する分子モーターである。 大人には大きく分けて2種類存在する。 細胞質内で物質輸送や配置、更には細胞分裂を担う細胞質ダイニンと鞭毛・繊毛の鞭打ち運動を引き起こしたり、鞭毛内での輸送を担う軸糸ダイニンである。 ダイニンをメインの研究テーマに据える際、私は特に細胞質ダイニンの運動メカニズムに注目している。以下、単にダイニン。 ダイニンは大雑把にモータードメインのホモ二量体からなる。ダイニンの運動を理解するには、まず、モータードメインの運動を理解する必要がある。 モータードメインは3,000 a.aを超える巨大な一本鎖からなり、機能に応じて複数のドメインに分割して扱われる。 配列のN末端から順に、Linker, AAA+ ring (AAA1 ~ AAA6), C末端となる。 AAA4の途中からstalkが突出しており、その先端には微小管結合ドメイン(MTBD)がある。 モータードメインのAAA1 ~ AAA4に一つずつATP結合サイトを有し、特に運動に最重要な結合箇所はAAA1である。 AAA1がATP/ADP+Pi状態ではpre構造、ADP/Apo状態ではpost構造を取ることが知られている。 pre/post間の大きな違いは二箇所:linkerとMTBDである linkerがpreではその先端がAAA2付近にあり、正面からは腕を折り曲げて居るように見える一方で、postではその先端がAAA5付近にあり、正面からは腕を伸ばして居るように見える。 この腕の曲げ伸ばし運動を指して、“power-stroke"と呼び、歩行運動に必要な力発生を行なっているものと考えられている。 次に、MTBDはpreでは微小管に対して弱結合状態、postでは強結合状態をとる。 つまり、モータードメインがATPの加水分解を行うことで、微小管親和性を更新しつつ力発生を行い運動するものと考えられている。 [Kubo et al., PLoS Comput. Biol. (2017)]において、モータードメイン内でこのpre/post間の構造変化がどのような経路を辿って完遂されているのかを調べた。